Unser Ziel ist es
das Leben von Patienten zu verbessern
Immatics ist ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Produktion von T-Zell-basierten Immuntherapien für die Behandlung von Krebs fokussiert.
In mehreren klinischen Studien untersuchen wir, wie wir das Potenzial von T-Zellen für die Behandlung von Krebspatienten nutzen können. Ziel dieser Studien ist es, innovative Immuntherapien zu entwickeln, die den Tumor eines Patienten selektiv und effektiv angreift.
Unser großes Ziel ist es, die Herausforderungen aktueller Krebstherapien zu überwinden und Krebspatienten neue therapeutische Möglichkeiten zur Verfügung zu stellen. Um die bestmöglichen Ergebnisse für Patienten zu erzielen, setzen wir uns mit Leidenschaft und unermüdlichem Einsatz für dieses Ziel ein.
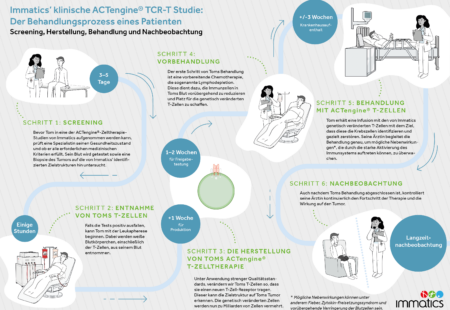
Klinische
Studien
Die folgenden drei klinischen Studien laufen aktuell und rekrutieren derzeit Patienten:
IMA203-101 (NCT03686124) untersucht die Sicherheit, Verträglichkeit und erste Anzeichen für die klinische Wirksamkeit von ACTengine® IMA203. IMA203 ist ein Zelltherapieansatz und richtet sich gegen solide Tumore, die das Antigen PRAME (preferentially expressed antigen in melanoma) auf ihrer Oberfläche tragen.
Zu diesen Tumoren gehören unter anderem Gebärmutterkrebs (Endometriumkarzinom und Uteruskarzinom), Eierstockkrebs, Melanome, verschiedene Sarkom-Subtypen sowie nicht-kleinzellige Plattenepithelkarzinome (NSCLC).
Für weitere Informationen zu dieser klinischen Studie, klicken Sie bitte hier.
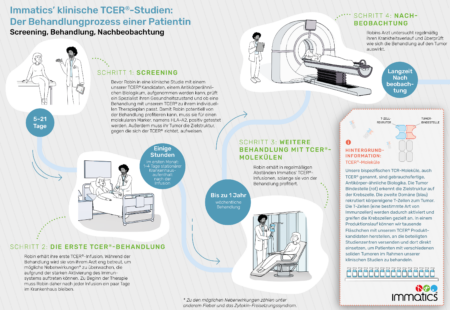
Die IMA401-101 Studie (NCT05359445) untersucht die Sicherheit, Verträglichkeit und erste Anti-Tumor-Aktivität von IMA401 bei Patienten mit wiederkehrenden und/oder schwer behandelbaren soliden Tumoren. TCER® IMA401 ist ein bispezifisches TCR-Molekül, das gegen die Zielstruktur MAGEA4/8 gerichtet ist und in Zusammenarbeit mit Bristol Myers Squibb entwickelt wird.
In der Phase-1-Studie wird IMA401 bei Patienten mit MAGEA4/8-positiven Tumoren untersucht. Zu diesen Tumoren zählen das nicht-kleinzelligen Plattenepithel-Lungenkarzinom (sqNSCLC), das kleinzellige Lungenkarzinom (SCLC), das Plattenepithel-Kopf-Hals-Karzinom (HNSCC), sowie Blasen-, Gebärmutter-, Ösophagus- und Ovarial-Krebs, Melanome, verschiedene Sarkom-Subtypen und andere solide Krebsarten.
Für weitere Informationen zu dieser klinischen Studie, klicken Sie bitte hier.
Die IMA402-101 Studie (NCT05958121) untersucht die Sicherheit, Verträglichkeit und Anti-Tumor-Aktivität von IMA402 bei Patienten mit wiederkehrenden und/oder schwer behandelbaren soliden Tumoren. TCER® IMA402 ist ein bispezifisches TCR-Molekül, das gegen die Zielstruktur PRAME gerichtet ist.
In der Phase-1/2-Studie wird IMA402 bei Patienten mit PRAME-positiven Tumoren untersucht. Zu diesen Tumoren zählen unter anderem kutanes und uveales Melanom, Eierstockkrebs, Lungenkrebs, Gebärmutterkrebs und das Synovialsarkom und andere solide Krebsarten.
Für weitere Informationen zu dieser klinischen Studie, klicken Sie bitte hier.
Aktive
Studienzentren:
USA:
The University of Texas MD Anderson Cancer Center – Houston, Texas
Columbia University Irving Medical Center – New York, New York
University of Chicago Medicine – Chicago, Illinois
UPMC Hillman Cancer Center – Pittsburgh, Pennsylvania
Europa:
Universitätsklinikum Bonn – Bonn, Germany
Klinikum Chemnitz Klinik für Innere Medizin III – Chemnitz, Germany
Universitätsklinikum Carl Gustav Carus Dresden – Dresden, Germany
Marien Hospital Düsseldorf – Düsseldorf, Germany
Universitätsklinikum Erlangen Interdisciplinary Clinical Trial Unit with ECTU – Erlangen, Germany
Universitätsklinikum Hamburg-Eppendorf – Hamburg, Germany
Comprehensive Cancer Center Tübingen-Stuttgart – Tübingen, Germany
Universitätsklinikum Würzburg – Würzburg, Germany
Sollten Sie an der Teilnahme an einer der klinischen Studien von Immatics‘ interessiert sein, sprechen Sie bitte mit Ihrem behandelnden Arzt.