ACTengine®
IMA203
als Monotherapie oder in Kombination mit Nivolumab bei wiederkehrenden und/ oder therapieresistenten soliden Tumoren
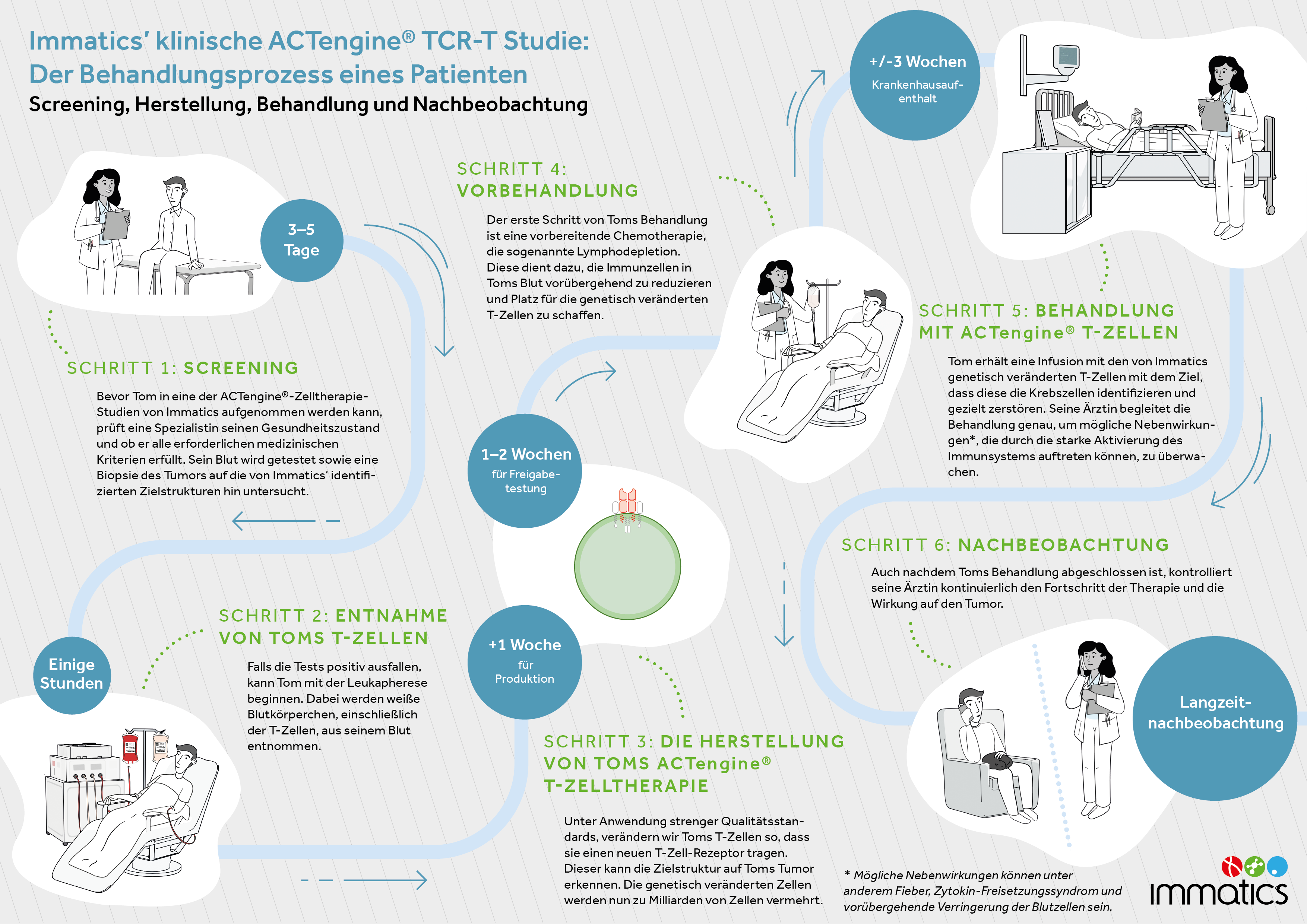
ACTengine® ist eine personalisierte Zelltherapie, bei der einem Patienten zunächst T-Zellen (Immunzellen) entnommen werden, um dann gentechnisch so verändert zu werden, dass sie Krebszellen erkennen und angreifen können. Die modifizierten T-Zellen werden dem Patienten anschließend als Teil seiner Behandlung wieder verabreicht.
Wenn Sie mehr über klinische Studien erfahren möchten, klicken Sie hier: Patient Engagement Through Education – EUPATI
Wenn Sie mehr über unseren ACTengine®-Ansatz erfahren möchten, klicken Sie hier: Adoptive Cell Therapies – Immatics
Klinische Studie
Übersicht
Bei IMA203-101 handelt es sich um eine klinische Phase-1-Studie (first-in-human) zur Untersuchung der Sicherheit, Verträglichkeit sowie erste Anzeichen der klinischen und biologischen Wirksamkeit von Immatics‘ ACTengine®-Zelltherapie IMA203 bei Patienten mit wiederkehrenden und/oder therapieresistenten soliden Tumoren. Der therapeutische Ansatz richtet sich gegen PRAME-positive Tumore, da dieses Peptid auf einer Vielzahl verschiedener solider Tumore vorkommt.
IMA203
- Eine Zelltherapie
Bei IMA203-101 handelt es sich um einen neuartigen Therapiekandidaten, der aktuell in klinischen Studien getestet wird und bis jetzt weder von der US-amerikanischen Food and Drug Administration (FDA) noch von einer anderen Aufsichtsbehörde für eine bestimmte Erkrankung zugelassen wurde.
Ziele der Studie
Das Ziel der klinischen Studie ist es, folgende Fragen zu beantworten:
- Ist die Behandlung mit ACTengine® IMA203 sicher, und treten mögliche Nebenwirkungen vorübergehend auf und sind diese behandelbar?
- Ist ACTengine® IMA203 in der Lage, das Tumorwachstum zu hemmen und die Tumorgröße zu verringern?
Zu den Nebenwirkungen können unter anderem Fieber und das sogenannte Zytokinfreisetzungssyndrom gehören.
Teilnahme
kriterien
Eine klinische Studie untersucht die Wirksamkeit und Sicherheit experimenteller Therapien. Wenn Sie sich für die Teilnahme an einer von Immatics‘ klinischen Studie interessieren, sprechen Sie bitte mit Ihrem behandelnden Arzt, um die Vorteile und Risiken einer solchen Behandlung abzuwägen und zu prüfen, ob diese in Ihren persönlichen Behandlungsplan passt.
SIE KÖNNEN SICH FÜR DIE KLINISCHE STUDIE QUALIFIZIEREN, WENN:
- Sie 18 Jahre oder älter sind
- Sie einen histologisch und pathologisch bestätigten, fortgeschrittenen und/oder metastasierenden soliden Tumor haben
- Sie positiv für die Blutgruppe mit dem HLA-Phänotyp HLA-A*02:01 sind
Die klinische Studie
IMA203-101
Wenn Sie diese Auswahlkriterien erfüllen, können Sie sich für eine Teilnahme an dieser klinischen Studie qualifizieren. Darüber hinaus gibt es allerdings weitere Teilnahmekriterien, die ausschließlich von einem Studienarzt beurteilt werden können.
Weitere Informationen für medizinisches Fachpersonal finden Sie unter:
TCR-engineered T Cells in Solid Tumors – Full Text View – ClinicalTrials.gov